
全国服务咨询热线:
400-665-0028
- 用友软件专业服务机构

特价活动:>>>> 畅云管家新购、续费7折优惠,畅捷通T+cloud、好会计、易代账、好业财、好生意云产品8折优惠。
生物制品认证要点
生物制品系指以天然或人工改造的微生物、寄生虫生物毒素或生物组织及代谢产物等为起始材料,采用生物学、分子生物学或生物化学等相应技术制成,并以相应分析技术控制中间产物和成品质量的生物活性制品,用于预防、治疗和诊断传染病或其他疾病。其硬件认证要点如下。
1. 不同生产工序操作必须有效隔离,不得相互妨碍。
2. 厂房洁净室(区)内表面(墙、地面、三棚等)应平整光滑、无裂缝、接口严密、无颗粒物脱落,并能耐受清洗和消毒,无积尘,不长霉。
3. 洁净室(区)的水、电、汽、建筑管线必须暗装。
4. 生产厂房必须按生产工艺和产品质量要求划分洁净级别,洁净室(区)内空气的尘埃粒子数和微生物数应符合规定,结果须予以记录。
5. 生物制品生产环境的空气洁净度级别要求:
(1)100级:灌装前不经除菌过滤的制品其配制、合并、灌封、冻干、加塞、添加稳定剂、佐剂、灭活剂等;
(2)10 000级:灌装前需经除菌过滤的制品其配制、合并、精制、添加稳定剂、佐剂、灭活剂、除菌过滤、超滤等;
(3)100 000级:原料血浆的合并、非低温提取、分装前的巴氏消毒、轧兽及制品最终容器的精洗等;
口服制剂其发酵培养密闭系统环境(暴露部分需无菌操作);
酶联免疫吸附试剂的包装、配液、分装、干燥;胶体金试剂、聚合酶链反应试剂(PCR)、纸片法试剂等体外免疫试剂;
深部组织创伤用制品和大面积体表创面用制品的配制、灌装。
6. 洁净室(区)的窗户、天棚及进入室内的管道、风口、灯具与墙壁或天棚的连接部位均应密封。
7. 100级洁净室(区)和无菌制剂灌封室不得设水池或地漏。
8. 生物制品生产车间必须与青霉素类、头孢菌素类、激素类、抗肿瘤类化学药品、同位素药品生产车间严格分开。
9. 同位素类生物制剂的生产厂房须符合国家关于放射保护的要求,并应获得同位素使用许可证。
10.生物制品的生产用菌毒种与非生产用菌毒种、生产用细胞与非生产用细胞、强毒与弱毒、死毒与活毒、脱毒前与脱毒后、含牛血清与不含牛血清的制品、活疫苗与灭活疫苗、人血液制品、预防制品等加工或灌装不得同时在同一生产厂房内进行,其贮存要严格分开。不同种类的活疫苗的处理及灌装应彼此分开。强毒微生物及芽胞菌制品的区域与相邻区域应保持相对负压,并有独立的空气净化系统。
11. 卡介苗生产厂废话 结核菌素生产厂房必须与其他制品生产厂房严格分开,其生产设备要专用。
12. 芽胞菌操作直至灭活过程完成之前必须使用专用设备。炭疽杆菌、肉毒梭状芽胞杆菌和破伤风梭状芽胞制品须在相应专用设施内生产。
13. 聚合酶链反应试剂(PCR)的生产和检定试剂,在使用阳性样品时,必须有符合相应规定的防护措施和设施。
14. 生产人免疫缺陷病毒(HIV)等检测试剂,在使用阳性样品时,必须有符合相应规定的防护措施和设施。
15. 以人血、人血浆或动物脏器、组织为原料生产制品必须使用专用设备,并与其他生物制品的生产严格分开。
16. 强毒微生物以及目前尚无有效预防治疗措施的有关病原微生物的加工处理,生产制品须在严格隔离的专用生产厂房内进行,操作致病性微生物须符合生物安全等级要求。
17. 不合格、回收或退回产品必须单独存放,并有明显标志。
18. 与制品直接接触的设备必须表面光洁、平整、易清洗、耐腐蚀,不与所加工的制品发生化学变化或吸附制品。
19. 纯化水、注射用水的生产设备必须保证水质质量。
20. 贮水罐、输入管道、管件阀门必须为无毒、耐腐蚀的材料制造。
21. 贮不罐密闭,通气口必须有不脱落纤维疏水性的除菌过滤装置,输水管道线能防止滞留,并易于拆洗、消毒。
22. 生物制品生产用菌毒种、细胞须按《中国生物制品规程》要求建立菌毒种、细胞原始种子库存和生产种子库。菌毒种、细胞来源必须历史清楚,能溯源,传代谱系清楚,并有记录。有菌毒种、细胞全面检定记录,出入库数量与登记数相符,在适宜条件下分库存放。
23. 物料的贮存条件下不得使其受潮、变质、污染或发生差错。
24. 麻醉药品、剧毒药品、放射性药品的验收、贮存、保管、使用、销毁必须严格执行国家有关规定。
附:生物制剂生产区域划分及工艺流程方框图(以基因工程冻干粉针剂为例)
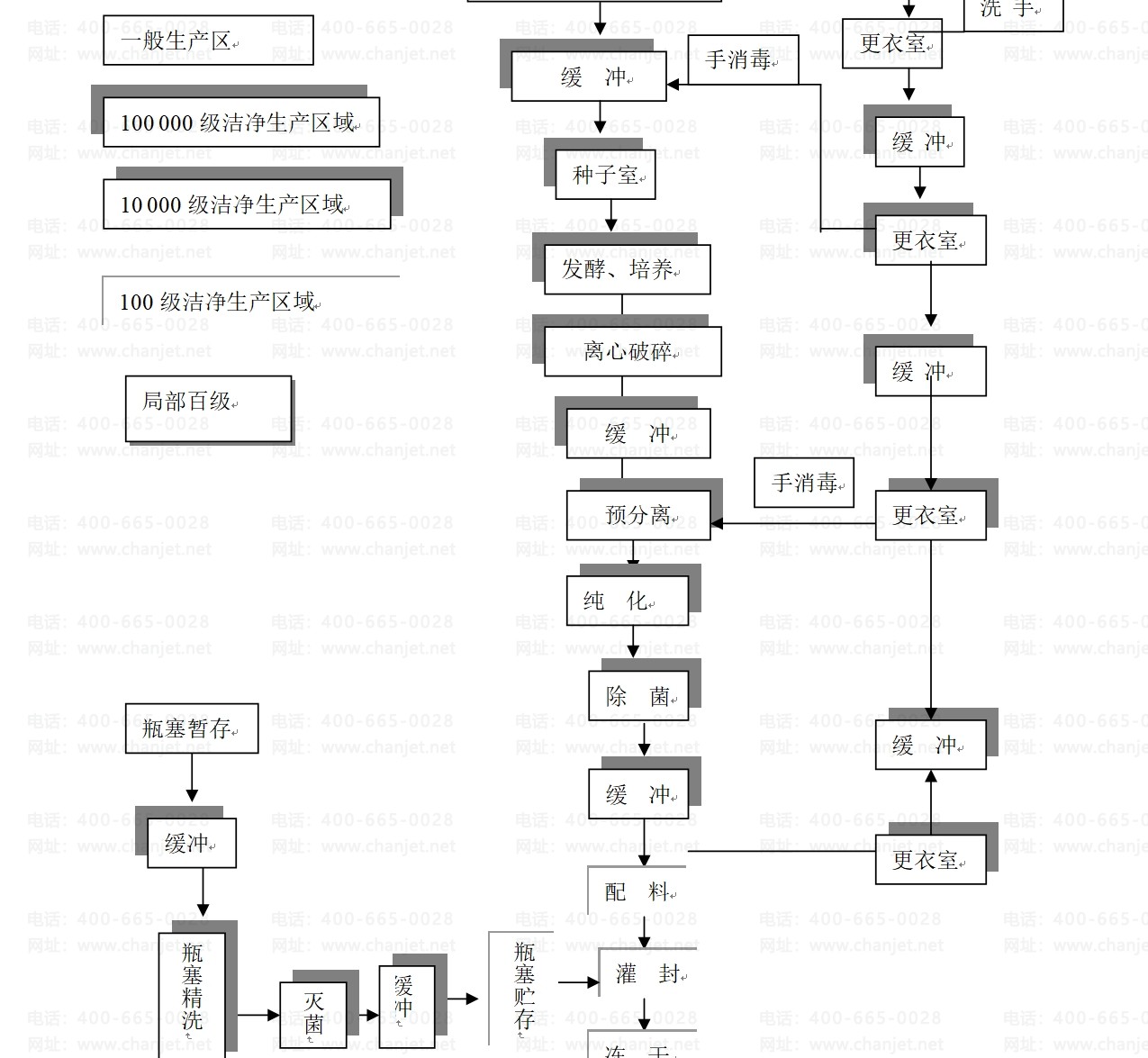
客服电话:400-665-0028
关键字:用友财务软件,畅捷通软件,财务软件,进销存软件,U9官网,用友U8,用友T1,用友T+,用友T3,用友T6,畅捷通好会计,好生意,智+好业财,用友培训服务售后公司,畅捷通运营培训服务公司
版权所有:用友畅捷通软件 Copyright © 2026 All rights reserved.